更新时间:2020-05-12
奶牛健康管理专家Todd Meyer(马国达)博士在第四届国际畜牧业创新论坛——规模化牧场奶牛营养、繁殖、健康管理峰会上,做了题为“奶牛布氏杆菌病”的专题讲座,通过布氏杆菌基本情况介绍,介绍了布病的检测方法,为牧场找寻出最适合的检测方法,并介绍了目前使用的疫苗及使用方法。

长按图片保存可分享至朋友圈
马国达博士首先带大家了解了布病的简史。大约2500年前,希波克拉底时期在地中海地区的绵羊和山羊中首次被发现。英国外科医生大卫布鲁斯博士于1887年首次从马耳他的感染者身上分离出梅利特布氏杆菌,布氏杆菌是以他的名字命名的。伯纳德·邦(丹麦)博士于1897年首次从牛身上分离出流产型布氏杆菌,家畜布氏杆菌病被广泛称为Bang病。约翰巴克博士(美国农业部)重新检查了他在办公桌上放了一年的流产型布氏杆菌培养物,看发生了什么,他观察到第19个培养皿中有一个突变株,其毒性较小,这成为了S19疫苗,S19于1941年首次使用。S19布氏杆菌最初是从一头名叫“马蒂尔达”的娟珊牛身上分离出来的。从那以后,疫苗接种(S19和RB51主要用于牛)和检测是全世界控制和根除布氏杆菌病程序的关键。很少有国家能在动物种群中彻底消灭这种疾病,每年全世界大约有50万新感染的人类感染病例。尽管全球关注控制和预防,但该病仍在许多国家和地区流行。
为何布氏杆菌病如此难以控制?首先,它能良好的适应宿主也就是牛。很好的隐藏在免疫系统中不受免疫系统的攻击。对于我们的来说很难检测和移除。大量携带者处于无临床症状状态或潜在感染。同时,这个潜伏期不固定,有可能时间很短也有可能时间很长。复杂的免疫过程会混淆检测结果与疫苗效果(有时候我们使用活苗会混淆检测结果,难以治疗)。同样,布病的管控方案和根除方案难以实施。
我们能从130年的科学积累中学到什么?50多年前的许多用于控制和管理的基本工具在现在仍被广泛使用。比如,S19疫苗依然在全世界广泛应用,凝集试验(血清凝集试验、虎红检测等)、补体结合检测依然是应用最广泛的方法。我们学习根除计划的田间试验中通过观察了解了畜群天然疾病如何在牧场成长。同样我们可以从攻毒实验和疫苗接种效果的研究确定在遏制疫情和使用疫苗方面的预期。攻毒实验现在全世界不太允许进行,所有我们现在看到的数据大多是50年前的数据,但依然可以学到很多东西。本报告中提到的大部分工作是在1950-1990年间完成的。
30-70年前的研究还是相关的!我们科学研究的历史还很短,但要从过去的经验学很多东西。了解过去有助于我们明白哪些新的信息是有用的。需要强调下攻毒实验因为生物安全问题,这项研究中的大部分已经不在世界任何地方进行了。
/ 布氏杆菌病的基本情况 /
布氏杆菌不会在宿主外复制,离开宿主是不会生长的。一旦进入环境,细菌就相对不稳定,生存能力有限(温暖干燥的环境会迅速杀死细菌)。传播风险主要是来源牛流产或牛正常产犊释放的大量细菌所致。所以布病是牧场管控环境的一个重要点。我们牧场的管控主要是管控传播途径。隔离受感染的牛,移除、填埋胎盘和排出的液体,清洁、消毒产犊区域对于减少新感染和打破感染周期都至关重要的。
流产或正常分娩的受感染奶牛的胎盘和体液是目前主要的感染源。一克胎盘子叶含有100,000,000,000 (1千亿)个生物体细菌 ,胎盘中有1,000克的子叶,一个胎盘含有大约100,000,000,000,000 (1 兆)个生物体,感染剂量被认为是1,000,000 (1 百万)个生物体。 一次流产/产犊可释放100000000(1亿个)剂量的布氏杆菌,一次流产/产犊可感染1亿个新动物体。所以这就是为什么管控牛生产或流产的排放物了,这是传播疾病的一个重要途径。
布氏杆菌不在牛体外繁殖的,只能存活下来。布氏杆菌喜欢在寒冷和潮湿的环境生存。布氏杆菌在草地可以存活的,在草地冬季可以存活100天,夏季30天。在干草中不适合生存,不大可能是畜群感染的来源。作为青贮饲料,pH值偏低,布氏杆菌在4.5或更低的pH值下不可能存活。所以饲喂饲养不太可能成为布病转播的途径。在粪便存活是要长一些的,有潜在的接触风险的,但很少有证据证明这是一种重要的感染源。
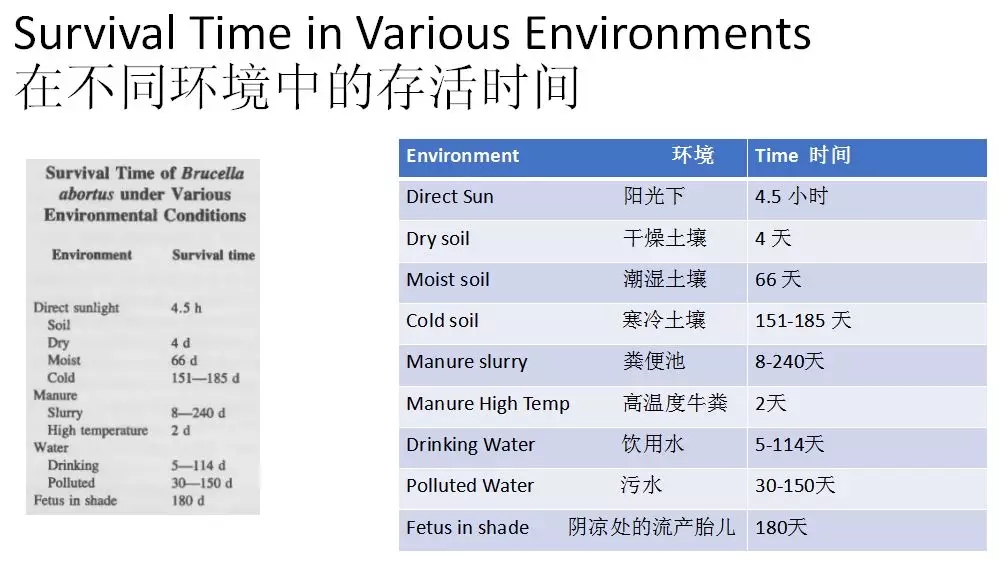
上图的调查数据显示,布氏杆菌在阳光下和干燥土壤中存活时间很短,在潮湿的土地上可以存活66天,在寒冷的土壤里可以存活2-3个月,在粪便中(受温度的影响)可以存活8天到4个月,在水中存活时间最长,能够存活3-4个月,在死亡的胎儿上(避免阳光直射)可以存活180天。
▨布氏杆菌病通过牛奶的传播
大部分的人是担心布病通过牛奶传播,约80%的布氏杆菌感染牛发生乳腺慢性感染,乳腺感染导致间歇性排毒布氏杆菌到牛奶中,可能持续数年,在产奶期的第一周(初期),细菌的含量可高达200000/ml,慢慢随后降至<2000/ml,这对于工人和消费者食用未经巴氏消毒的乳制品带来了感染风险。虽然对于一个成母牛和另一个成母牛这不是一个常见的传染来源。但我们要把感染奶牛的牛奶饲喂犊牛是可行的传染途径。所以在饲喂犊牛时一定要经过巴氏杀菌。
▨布氏杆菌存在潜在感染
布氏杆菌存在潜在感染,在牛首次产犊前,经常出现青年牛检测阴性,但该青年牛可能是过去感染性接触的无症状携带者,这是检测和屠宰计划失败造成的,在这些计划中,阳性动物全部被出售,但当被感染动物的后代再次产犊时,疾病依然存在,出现这些感染的一个可能的情况是犊牛早期暴露和菌血症,随后细菌进入淋巴组织并处于休眠期,直到再次出现第二种菌血症,并有可能侵入怀孕子宫。尽管犊牛可能通过子宫内,分娩期间,初乳和牛奶暴露感染,但一般认为犊牛对新的感染有很强的抵抗力,直到他们怀孕的最后三个月。
▨潜在感染多常见?
这个问题无法完全回答。根据文献由阳性母牛生的犊牛有高达10%的潜在感染率(Fensterbank,1978年),另一个在英国的研究中有2.5%的潜在感染率(Wilesmith,1978年),这是基于当时可用的检测,这两个文献是在7/8年以前。由阴性母牛生的犊牛也有潜在感染的风险,这表明出生后暴露风险也是一个感染因素。在受感染的牛群中,很难区分潜在感染和在妊娠晚期或产犊前形成的感染。一胎产奶牛的高比例感染可能是由于潜在感染和快速爆发感染共同造成的(未感染动物暴露于产犊或流产造成污染的高危牛群中)。
马国达博士介绍了攻毒实验、大型田间试验和Nicoletti 1977在佛罗里达田间试验,通过实验总结得出:大型奶牛场在管理上更难控制疫情爆发。大于500头规模的奶牛场往往新感染率高而且净化很慢不容易控制疾病爆发,大型牧场很难分离已知感染的奶牛,血清阴性的携带者可在分娩或流产时感染许多牛,对大型牧场来说,更难打破新的感染周期。当检测无效时(缺乏先进的检测方法),给全群成母牛免疫(犊牛期间没有免疫过的)是很有用的。

通过对新西兰6个牧场的试验研究发现:慢性感染牛群的表现可能不同于典型的新爆发牛群。慢性感染牛群的临床流产率可能不会异常高(接种疫苗,自然接触可提高免疫力并降低严重程度)。产犊前的感染可以解释为何产犊时培养结果阳性和血清学阴性,感染潜伏期可能是产犊前血清学阴性的原因。大量受感染的动物可能出现临床正常,血液检测呈阴性,但是依然传播细菌。血清学检测并不总是一致的,需要多次测试(由于传统检测的敏感性和特异性低)。
/ 布病的检测 /
布病的检测过程非常复杂,因为细菌能够隐藏在组织中。“金标准”检测是对生物体进行细菌培养(细菌培养很缓慢,可能造成假阴性;在胎盘/子宫分泌物、牛奶、胎儿或淋巴结中可发现细菌),在现实中这不可能实现,现在牧场真正应用的现场诊断依赖于血清学,许多受感染的奶牛在流产或正常产犊前都没有检测出阳性,这使得它在确认感染之前可以传播给牛群。
▨布病的基础免疫检测
一般使用传统检测虎红检测,还有标准试管凝集试验、补体结合试验。传统的检测使用完整的S(光滑)布氏杆菌细胞或S-脂多糖抗原(S-LPS)提取物。而现在新的检测核心O-多糖抗原,这种检测可以通过荧光偏振法、一些酶联免疫吸附检测。这种检测更敏感、更准确可以给淘汰牛带来更多指导意义。另外,这些抗原存在于田间菌株和S19疫苗中,都可以被检测阳性。所以牧场进行S19疫苗免疫,传统上的检测将没有意义。
▨流行病学检测定义
灵敏度定义是检测出阳性是牛群中真实阳性。也就是说牛群真能检测出阳性的多少。特异性是检测出阴性真实阴性的数,也就是说牛群中真正挑出阴性的牛。
案例:
5000头牛的牧场,检测疾病发生率与检测灵敏度和特异性的关系。有效管理方案受到检测敏感性和特异性的影响。
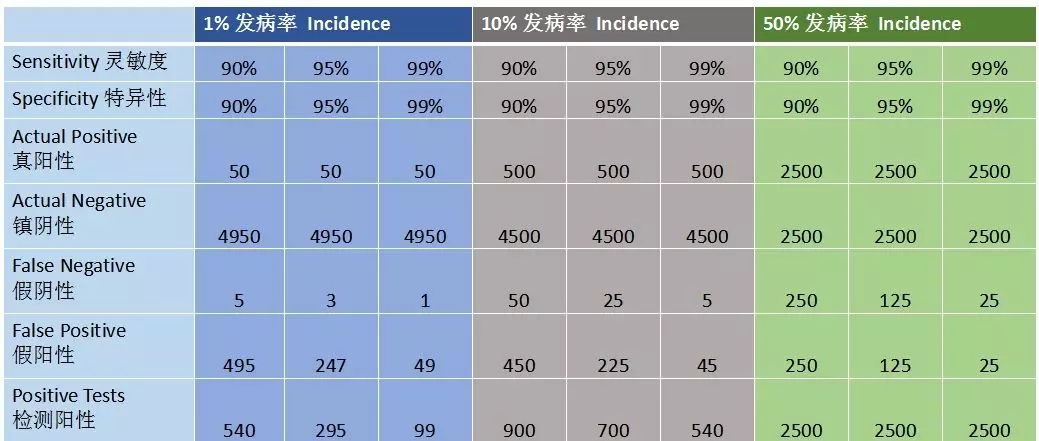
假设1%、10%、50%三种发病率情况,灵敏性、特异性都设置为90%、95%、99%三个值,通过发病率可以算出真阳性、真阴性比例。通过灵敏性定义去算这里面多少是假阴性、假阳性。按照5000头牧场1%发病率情况,如果检测的灵敏性、特异性都是90%,会检测出4950头阴性牛,其实只有50头是真阳性,会有5头假阴性,意味着会有495假阳性出现,如果这个牧场采用检测加淘汰清理布病的情况下,这个牧场可能就会关门了。这就意味着对于牧场实行淘汰方案检测准确的重要性。比如检测灵敏性、特异性提高到99%,检测阳性只有99头了,你淘汰的就少了,所以理解检测的作用是非常重要的。同时,有效管理方案受到检测敏感性和特异性的影响。
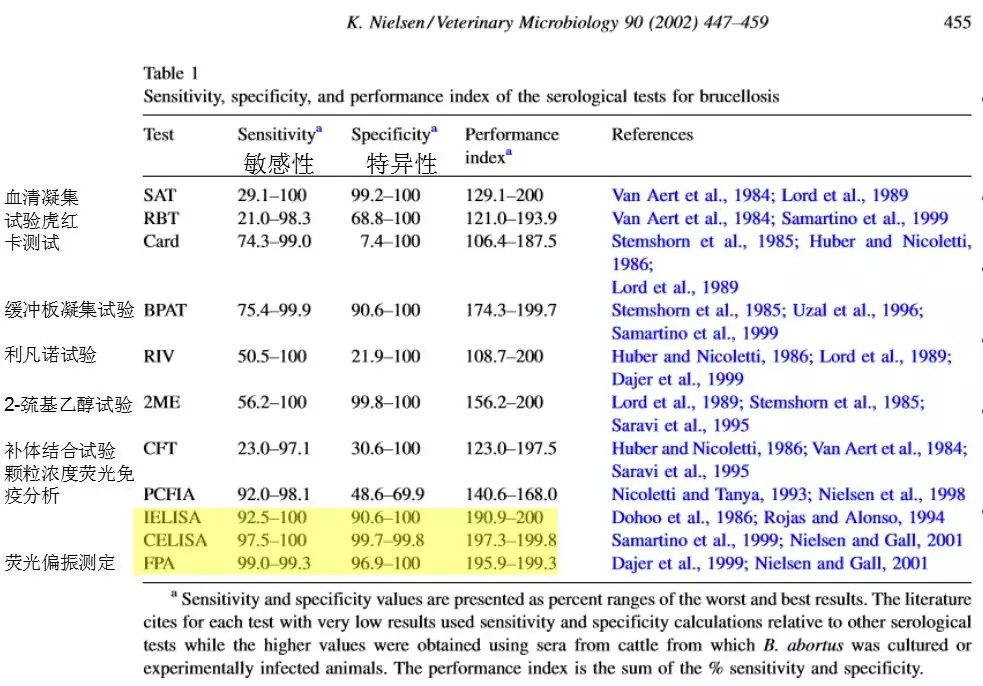
上图是根据各种文献进行整理后得出的敏感性和特异性。灵敏性推行的范围是非常大的,从30%到100%,数值这么低一定受到了其他因素的影响,但是我们经常可以发现有些检测的灵敏性和特异性过低,所以你不能基于它进行淘汰和检测。这也是为什么前面几个用传统方法控制布病失败的原因。图中用黄色加亮的这部分是荧光偏振法和Elisa,数据显示在真实的田间或者牧场,这些检测的灵敏性和特异性聚在一个很高的水平。试验证明,常见检测的敏感性和特异性,最有效的检测方法是荧光偏振法和Elisa。
选择检测的标准参考以下几点:
1.高敏感性(发现阳性奶牛)
2.高特异性(避免假阳性和不必要的淘汰)
3.便宜(更低的成本可以支持更频繁的检测)
4.方便(易在农场实验室进行,可重复可定量)
我个人建议是Elisa和荧光偏振法,比较适合牧场的检测。
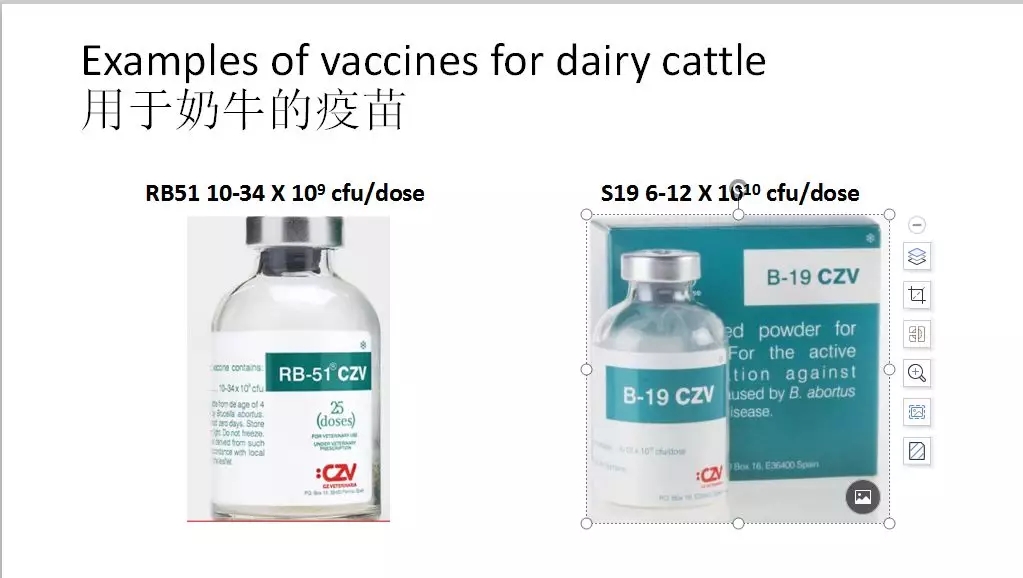
照片所显示的是市面上常见的RB51和S19疫苗。
疫苗免疫会对传统检测有一些干扰,注射疫苗的时间大概是4月到8月之间,检测时间除了第一个是在15个月到17.5个月,其他都集中在22到26个月之间,应用的疫苗是S19,这里应用的检测是虎红检测,在第一个15个月到17.5个月中,50%的检测是阳性,也就是疫苗注射后的十个月;如果把检测推后的话,检测阳性值要低很多,但还是在20%左右,这就是对疫苗检测的干扰。即使在刚产犊的时候,我们依然会检测出很多阳性。所以你不能基于这个检测结果就对牛进行淘汰处理,因为有可能是疫苗反应。而荧光偏振法就可以给大家一个数量级的结果,你可以通过这个数量级分析是疫苗免疫产生的阳性还是真正被感染的结果。
RB51疫苗是由流产布氏杆菌的一种有毒形式的粗糙突变株制成,该疫苗株缺乏在田间株细胞壁中发现的脂多糖O侧链。接种过疫苗的动物对检测成阴性结果,这使得继续检测流程不受影响,常用于包括美国在内的许多国家。有报告显示,出现过在接种布氏杆菌S19和RB51疫苗后持续感染,偶尔能从接种过疫苗的牛的牛奶、胎盘和胎儿中分离出疫苗菌株。一项研究发现,在接种S19疫苗后9-12个月内,有2.5%的牛体内有活细菌,持续性疫苗接种感染的估计值在1/100000剂量到大约0.5%之间变化很大。
在许多情况下,疫苗的持续感染仅限于淋巴结和乳腺,通常不会造成伤害。疫苗菌株是对在怀孕子宫中发现的一种糖赤藓糖醇敏感的突变品种。然而,疫苗菌株可能变回能够定植子宫的赤藓糖醇耐受菌株,并导致临床流产和模拟田间菌株感染的感染。这些突变的疫苗株在S19和RB51导致的流产中都被发现过。疫苗接种时的剂量、年龄和妊娠期可能是疫苗感染的潜在因素。

美国曾经报导了一篇人类喝未经巴氏消毒的造成的RB51布病感染,在过去的几年中一共出现了三个案例。所以,在美国直接去喝生奶的人只是少部分,所以这个感染大概率是由环境造成的,并不是因为生奶。
▨管理在布病管控中的作用
牧场的管理在布病防控中非常重要,这是一个场长需要做的部分。除了疫苗接种和检测之外,牧场还必须实施管理措施,打破新感染的周期,减少感染剂量至关重要(感染剂量几乎完全是由于受感染奶牛流产或产犊造成的),尽快识别、隔离或淘汰阳性动物,采取隔离和检测等所有方法减少阴性牛接触的细菌的风险,做好高风险地区的卫生管控,防止受感染的动物再次在牧场产犊(淘汰或禁止配种)。
▨牛场的卫生管理
布鲁氏杆菌病是人畜共患的疾病,工人的安全是至关重要的,当你处理阳性牛的时候要始终穿戴个人防护装备。
密切监测怀孕晚期和产房的异常产犊情况(产房和围产区)。产犊后期的牛以及产房需要格外的关注,隔离已知阳性牛在特定区域产犊,产房分为多个独立的小区远比一个开放的区域风险小,安全的丢弃处理胎盘并用土覆盖污染区域,在产犊后的四周是感染风险最大的,产后把阳性牛和可疑牛分离应饲养4周,一定要将犊牛尽早与母牛和其他犊牛分离开,然后单独饲养,犊牛岛是一个很好的方案。所有的初乳和常奶一定要饲喂巴杀过的牛奶。
▨疫苗保护与暴露
“如果环境中的细菌量增加10倍,疫苗的保护程度可从大约70%降低到50%,因此,很明显,只有正确的免疫流程配合良好的管理才能增加免疫成功的概率。最危险的时期是在流产和正常产犊时以及之后的一段时间,在隔离的区域产犊可以有效的控制疾病的传播”。 这句话是一位医学博士在50年前说的,我非常认同,我们不仅要有正确的疫苗,还要配合管理流程,才能达到更好的免疫效果。最危险的就是在流产和正常产犊及产犊之后的这段时间,所以这些传染可以被很好地控制,如果你隔离出产犊区域(单独为阳性牛),我们要遵循良好的管理方案才能控制疾病。

长按图片保存可分享至朋友圈
文章来源:奶牛微刊